現在とりくんでいる研究テーマ
脳・脊髄から構成される中枢神経系は様々な高次機能を制御しており、これらの異常が神経変性疾患や精神疾患、慢性疼痛といった疾患を引き起こすといわれています。中枢神経系はその名が示すように神経細胞が主な構成成分ですが、その他にも様々な細胞が存在しています。その一つがアストロサイトやミクログリアといったグリア細胞です。近年の研究からグリア細胞の機能異常が、多くの中枢神経疾患に関与していることが明らかになってきています。そこで我々の研究室では、特に慢性疼痛と気分障害の病態におけるグリア細胞の役割をさまざまな角度から解析しています。
1. 疼痛におけるグリア細胞の役割
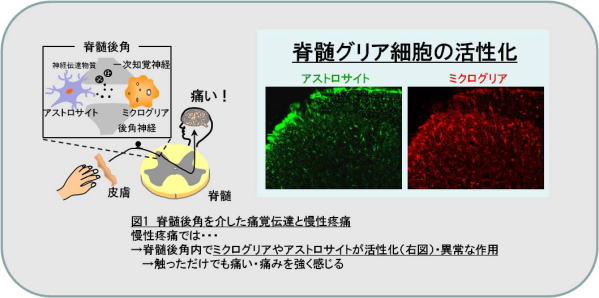
慢性疼痛の有病率は成人人口の22.5%と推定されています。高齢化やストレス社会を背景に有病率は今後も増加することが予想されています。慢性疼痛には慢性的な炎症が原因となる関節リウマチや変形関節症などの炎症性疼痛、末梢神経や中枢神経が直接損傷されることに起因する帯状疱疹後神経痛、糖尿病性疼痛などの神経障害性疼痛、組織のどこにも発痛物質や炎症は存在せず、また神経損傷も認められないにもかかわらず全身に痛みを生じる線維筋痛症や慢性腰痛などの非器質性疼痛が挙げられます。これらの慢性疼痛はモルヒネなどのオピオイドやロキソニン・インドメタシン等の非ステロイド性抗炎症薬(NSAIDs)といった既存の鎮痛薬が奏功しにくいといわれています。それ故、新たな作用メカニズムを有する鎮痛薬の創薬が必要不可欠です。その慢性疼痛治療の新たな標的として注目されているのがグリア細胞(ミクログリア・アストロサイト)です。最近の研究から、脊髄や脳に存在するグリア細胞の機能異常が慢性疼痛の惹起に関与していることが明らかとなってきています(図1)。そこで我々は、グリア細胞活性を制御するメカニズムが新たな鎮痛薬開発のヒントとなるのではないかと考え、研究を行なっています。
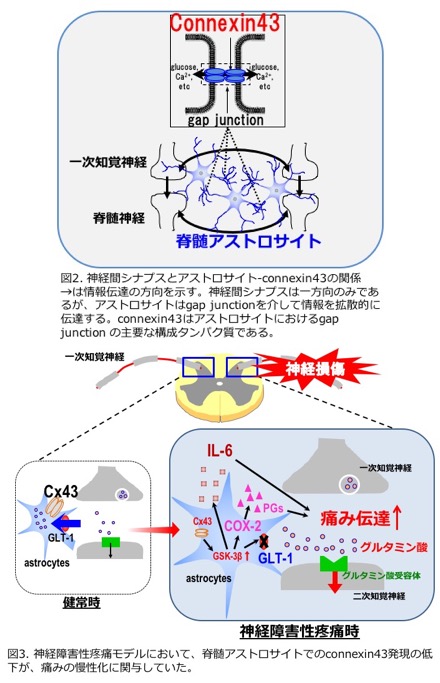
アストロサイトはgap junctionと呼ばれる細胞間輸送機構を介して中枢神経内に巨大なネットワークを形成し、単一シナプスだけではなく広範囲に様々な情報を伝達する役割を担っています(図2)。アストロサイトに発現するgap junctionは、主にconnexin43と呼ばれるタンパク分子の六量体が細胞間で結合することにより形成される低分子輸送体であり、Ca2+、cAMP、イノシトール3リン酸、ATPやグルコースなどを伝播させるほか、細胞外におけるpH、K+濃度を調節することにより神経伝達機能に重要な役割を果たしていることが報告されています。最近、アストロサイトにおけるconnexin43-gap junction機能の破綻が、てんかんや多発性硬化症などの炎症疾患に関連していることが明らかとなっています。そこで当研究室では、てんかんや炎症などの脳疾患と慢性疼痛発症の病態メカニズムには神経シナプス伝達の過剰亢進が関与しているという類似性があることに着目し、脊髄アストロサイトにおけるconnexin43機能の破綻が疼痛の慢性化に何らかの関わりがあると考え研究を行っています。
これまでに坐骨神経損傷により発症させた神経障害性疼痛モデルマウスの脊髄腰髄部後角において、痛みの閾値の低下に相関してconnexin43発現が著明に低下していることを見出しました。さらに脊髄後角でのconnexin43発現低下は、グルタミン酸神経伝達を亢進させ、痛みを惹起していることが明らかとなりました。またウイルスベクターを用いて、脊髄後角のconnexin43発現を回復させると、痛みが減弱することもわかりました (2015年7月3日付の日経産業新聞、Brain, Behav., and Immun., 2015)。また、神経障害性疼痛モデル、および培養脊髄アストロサイトを用いた検討により、connexin43発現低下は、interleukin-6、cyclooxygenase-2の発現を増加させ、さらにグルタミン酸トランスポーターGLT-1の発現を低下させることで、痛み伝達を亢進していることが明らかとなっています(GLIA, 2017)。加えて、connexin43発現低下がこのような疼痛誘発物質の発現変動を惹起する原因としてglycogen synthase kinase-3βの活性化が重要な役割を果たしていることを同定しています(図3)。
また神経障害性疼痛モデル、および培養脊髄アストロサイトを用いた検討により、炎症性サイトカインの一つである腫瘍壊死因子(TNF)がconnexin43発現低下に重要な役割を果たしていることを見出し、さらに そのメカニズムにはユビキチン-プロテアソーム系の賦活化によるconnexin43分解促進作用が関与していることも明らかとなりました(J. Neurosci. Res., 2013; Brain, Behav., and Immun., 2015; Biochem. Biophys. Res. Commun., 2015)。
一方で、トマトに含まれるカロテノイドであるリコピンがconnexin43発現増加作用を有しており、さらに神経障害性疼痛に対して鎮痛効果を発揮することを明らかにしました(Life Sci., 2016)。現在、より強力なconnexin43発現増加作用を有する化合物のスクリーニング系の構築を目指しており、そこから新たな鎮痛薬候補を探索していきたいと考えています。
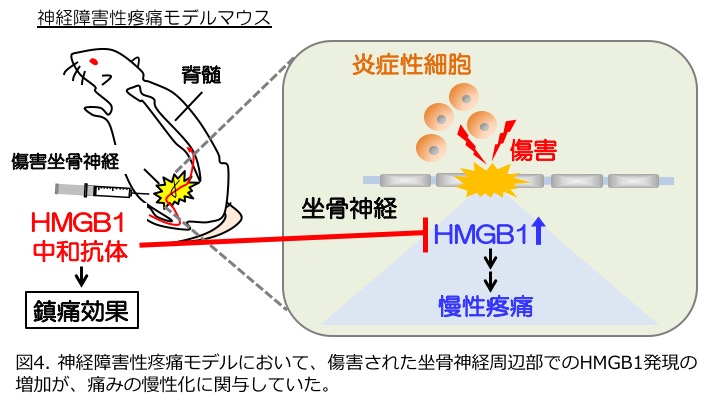
中和抗体は中枢部位には作用しにくいことが報告されており、HMGB1に対する中和抗体は、中枢部位だけではなく末梢部位(傷害神経)にも作用することで、痛みが緩和している可能性が考えられます。また中和抗体を全身に投与することは、副作用の発生頻度を増加させる恐れがあります。そのため、より安全性の高い、病変部位への局所投与により鎮痛効果が得られることが実証されれば、HMGB1に対する中和抗体の鎮痛薬としての有用性がさらに高まると思われます。そこで、神経障害性疼痛モデルマウスにおける傷害坐骨神経でのHMGB1の発現変化と、HMGB1に対する中和抗体を局所投与することによる鎮痛効果を検討しました。その結果、神経障害性疼痛モデルマウスの傷害坐骨神経において、対照群(神経に傷害のないマウス群)と比較してHMGB1発現量が増加することを明らかにしました。またこの増加は、傷害によって集積した炎症性細胞に依存していることが分かりました。さらに、傷害坐骨神経の周辺部にHMGB1に対する中和抗体を投与することにより、痛みが有意に緩和されることを発見しました。また傷害坐骨神経の周辺部で増加したHMGB1は、さらに別の痛み誘発物質を増加させることで痛みを慢性化させていることも明らかになりました(2015年12月3日付の日経産業新聞、J. Neurochem., 2016、図4)。
私たちの身体には1日周期のリズム、いわゆるサーカディアンリズムが存在しており、これらは「時計遺伝子」とよばれる複数の遺伝子群により制御されています。近年の研究により、サーカディアンリズムは様々な生体機能を司っていることが明らかになっています。さらにこのリズムの異常が睡眠障害、循環器疾患、メタボリックシンドロームなどの発症に密接に関わっていることが示唆されています。
グリア細胞が密接に関与しているパーキンソン病やうつ病の発症にも、リズム異常が関与して可能性が報告されています。こういった背景から我々は、慢性疼痛と脊髄グリア細胞における時計遺伝子の役割に着目しています。これまでグリア細胞における時計遺伝子の役割についてはほとんど報告がありませんが、新たなグリア機能制御機構としての可能性が予想されます。これまでに我々はグリア細胞にも時計遺伝子が存在しており、刺激に応じて発現レベルが変化することを明らかにしました(J. Pharmacol. Sci., 2010, Neuroscience, 2011)。さらに疼痛伝達において重要な部位である脊髄において、複数の時計遺伝子やシクロオキシゲナーゼ-1やグルタミン合成酵素といった疼痛伝達に寄与する因子の発現に明確なサーカディアンリズムが存在していることがわかりました。この現象は、痛みの感受性に一日の中で違いがある要因かもしれません。またこの脊髄でのサーカディアンリズム形成は、脊髄くも膜下腔内にアストロサイト阻害薬を投与しておくと著しく消失したことから、脊髄アストロサイトがリズム形成に重要な役割を担っていることが予想されます(Neurochem. Int., 2012)。
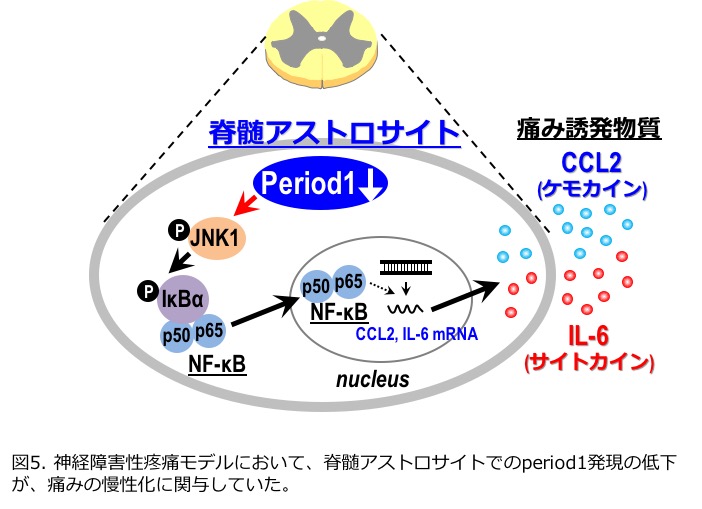
また最近、脊髄アストロサイトの時計遺伝子群が慢性疼痛発症に重要な役割を担っていることもわかってきました。特に培養脊髄アストロサイトにおけるperiod1(Per1; 代表的な時計遺伝子の一つ)発現をRNA干渉法によりノックダウンさせると、炎症性物質(CCL2、interleukin-6)の発現が著明に増加することが明らかとなり、さらにこれらの増加作用の細胞内メカニズムを検討した結果、Per1発現が低下した脊髄アストロサイトではc-jun N-terminal kinase(JNK)の活性化ならびにNF-κBの核内移行が著明に惹起されていることが判明しました(Mol. Cell. Neurosci., 2014)。加えて、神経障害性疼痛モデルマウスの脊髄後角アストロサイトでもPer1発現が低下しており、また脊髄後角でのPer1発現を強制的にノックダウンするとJNK活性化を介してCCL2産生を増加させることで痛みを惹起させることを示しました(Mol. Cell. Neurosci., 2016、図5)。
さらに別の時計遺伝子Rev-erbがアストロサイトにおける炎症性物質産生の制御に関与している可能性を明らかにし(Biochem. Biophys. Res. Commun., 2016)、Rev-erb活性を制御する薬物が新たな鎮痛薬となる可能性についても解析を進めているところです。
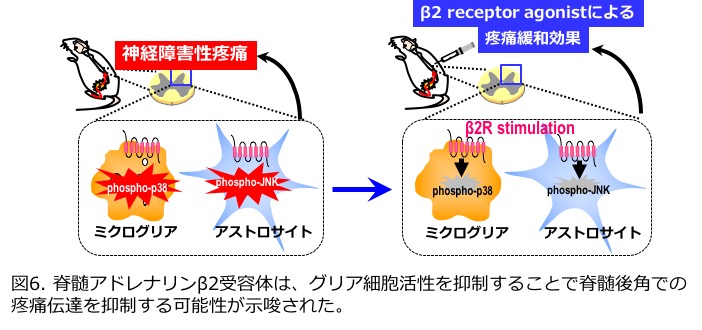
最近、三環系抗うつ薬などのモノアミントランスポーター阻害薬が鎮痛効果を発揮することが明らかとなり、神経障害性疼痛などに臨床応用されています。一方で、その作用メカニズムについては様々な研究報告がなされています。我々は、モノアミントランスポーター阻害により増加するノルアドレナリンが脊髄グリア細胞活性を抑制するのではないかと推測し、その作用について研究を行っています。脊髄ミクログリアをノルアドレナリンで刺激しておくと、アドレナリンβ受容体を介してミクログリア活性化の指標であるp38MAPキナーゼのリン酸化や腫瘍壊死因子(TNF)の産生が著明に抑制されることを見出しました(Neurochem.Int., 2009)。また、脊髄アストロサイトに発現するアドレナリンβ受容体を刺激することにより、アストロサイト活性化の指標であるJNKリン酸化反応と、それに引き続いて誘導される炎症性ケモカインCCL2産生が著明に抑制される機構も存在していることが明らかとなりました(J. Cell Physiol., 2014)。加えて、神経障害性疼痛モデルに対して、β2アドレナリン受容体作動薬を脊髄くも膜下腔内に投与しますと疼痛が緩和され、かつ脊髄後角で認められるミクログリアとアストロサイトの活性化が減弱することが明らかになりました(Neurochem. Int., 2016, 図6)。
2. 精神疾患におけるグリア細胞の役割
脳は神経細胞だけではなくグリア細胞(アストロサイト・ミクログリア・オリゴデンドロサイト)や血管を構築している血管内皮細胞など多様な細胞により構成されています。哺乳類の脳では神経細胞の数の数倍~数十倍のグリア細胞が存在し、グリア細胞が積極的に脳機能に関与することが知られています。近年、高次脳機能や精神疾患との関連も数多く報告され、うつ病においてもグリア細胞の役割が注目されています。
我々は抗うつ薬の新しいターゲットとしてグリア細胞に着目し、グリア細胞における抗うつ薬の薬理作用を細胞生物学的、神経化学的手法などを用いて研究を行っております。これまでに、抗うつ薬がグリア細胞においてグリア細胞由来神経栄養因子(GDNF)の発現を誘導することを見出しました(J. Neurochem., 2001)。さらに、グリア細胞における抗うつ薬のGDNF誘導作用は、従来から抗うつ薬の薬理作用として知られているモノアミン再取り込み阻害作用とは関係なく、Gi/oタンパク質の活性化を介する新規薬理作用が関与することを明らかにしました(J Biol Chem., 2015)。また、ラット初代培養アストロサイトにおいて抗うつ薬が線維芽細胞増殖因子(FGF-2)を転写因子Egr-1の生合成を介して増加することを報告しました(J. Neurochem., 2015)。さらに最近、アストロサイトに発現するconnexin43-gap junction機能の低下がうつ病発症と密接な関係にあることが報告されていますが、我々はラット初代培養アストロサイトに抗うつ薬を処置することでconnexin43-gap junction発現及び機能が上昇することを突き止めました(Br. J. Pharmacol., 2014)。現在、これらの作用の薬理的意義やメカニズム等の詳細に関する研究を行っております。これらの基礎研究から得られた知見を基にして、将来的には精神疾患の病態を解明し、新たな診断・治療法の開発や創薬につなげることを目指しています。
痛みが情動面におよぼす影響に関しては、未だ不明瞭な点が多いのが現状です。痛みによる不快情動は、生体警告系の役割を担う面では重要ですが、持続的な痛みに起因する不快情動は、QOL低下のみならず、精神疾患発症の引き金にもなることが知られています。実際に、慢性疼痛患者において、うつ病・不安症などの精神疾患が発症する割合が高いことが報告されています。一方で、精神疾患が痛みを増悪させることも知られていることから、悪循環が生じて疼痛が慢性化・複雑化していると考えられています。したがって、痛みの感覚面だけでなく情動面にも考慮した慢性疼痛治療の必要性、さらには、その基盤となる基礎的知見の集積が求められています。我々は、行動薬理学的手法や免疫組織化学的手法といった様々な実験技術を用いて、脳における炎症免疫機構に関わるグリア細胞(アストロサイト、ミクログリア)の役割に着目しつつ、慢性疼痛とうつ病に共通する病態基盤を明らかにし、新たな治療薬創製に向けた研究を行っています。
3. 疼痛における線条体の役割
これまでに、線条体を損傷している患者さんや、線条体が主要病変部位であるパーキンソン病の患者さんでは、疼痛を併発している割合が高いことが報告されています。線条体は大脳基底核の構成要素であり運動機能に深くかかわる脳部位としてよく知られていますが、疼痛との関係性は依然不明な点が多いのが現状です。そこで我々の研究室では線条体の疼痛時の役割に着目し検討を行っています。
以前より我々の研究室では、脊髄後角において痛覚情報を伝達する神経ペプチド・サブスタンス P (SP) の一次知覚神経における役割について研究してきました。
線条体にもこの SP の受容体である Neurokinin 1 (NK1) 受容体が、豊富に存在していることが報告されています。また、これまでに脳内における SP は疼痛をむしろ抑制することが知られていましたが、
どの脳部位に作用し疼痛を制御しているのかは不明でした。そこで、線条体における SP 神経系が疼痛を抑制的に制御するのではないかと考え研究を行っております。
これまでに、ホルマリン投与による仮性疼痛反応時の線条体において SP mRNA (preprotachykinin-A mRNA) 産生が増加し、さらに SP が遊離することを見出しました (J. Pharmacol. Sci., 2013)。この遊離した SP は線条体を拡散し、NK1 受容体を活性化させ細胞内シグナルである Extracellular signal-regulated kinase 1/2 のリン酸化を介して、疼痛抑制効果を示すことを明らかにしました。(J. Neurochem., 2014)。さらに、この SP の疼痛抑制効果は急性痛は抑制せず、持続する疼痛のみを作用する可能性が示唆されております。今後、疼痛時における線条体 SP の詳細な役割を検討することにより、正常時の痛覚情報伝達に影響せず、病体時の過剰な疼痛のみに効果を有する新規鎮痛薬ターゲットの発見に繋がる可能性が期待できます。

 アストロサイトはgap junctionと呼ばれる細胞間輸送機構を介して中枢神経内に巨大なネットワークを形成し、単一シナプスだけではなく広範囲に様々な情報を伝達する役割を担っています(図2)。アストロサイトに発現するgap junctionは、主にconnexin43と呼ばれるタンパク分子の六量体が細胞間で結合することにより形成される低分子輸送体であり、Ca2+、cAMP、イノシトール3リン酸、ATPやグルコースなどを伝播させるほか、細胞外におけるpH、K+濃度を調節することにより神経伝達機能に重要な役割を果たしていることが報告されています。最近、アストロサイトにおけるconnexin43-gap junction機能の破綻が、てんかんや多発性硬化症などの炎症疾患に関連していることが明らかとなっています。そこで当研究室では、てんかんや炎症などの脳疾患と慢性疼痛発症の病態メカニズムには神経シナプス伝達の過剰亢進が関与しているという類似性があることに着目し、脊髄アストロサイトにおけるconnexin43機能の破綻が疼痛の慢性化に何らかの関わりがあると考え研究を行っています。
アストロサイトはgap junctionと呼ばれる細胞間輸送機構を介して中枢神経内に巨大なネットワークを形成し、単一シナプスだけではなく広範囲に様々な情報を伝達する役割を担っています(図2)。アストロサイトに発現するgap junctionは、主にconnexin43と呼ばれるタンパク分子の六量体が細胞間で結合することにより形成される低分子輸送体であり、Ca2+、cAMP、イノシトール3リン酸、ATPやグルコースなどを伝播させるほか、細胞外におけるpH、K+濃度を調節することにより神経伝達機能に重要な役割を果たしていることが報告されています。最近、アストロサイトにおけるconnexin43-gap junction機能の破綻が、てんかんや多発性硬化症などの炎症疾患に関連していることが明らかとなっています。そこで当研究室では、てんかんや炎症などの脳疾患と慢性疼痛発症の病態メカニズムには神経シナプス伝達の過剰亢進が関与しているという類似性があることに着目し、脊髄アストロサイトにおけるconnexin43機能の破綻が疼痛の慢性化に何らかの関わりがあると考え研究を行っています。 中和抗体は中枢部位には作用しにくいことが報告されており、HMGB1に対する中和抗体は、中枢部位だけではなく末梢部位(傷害神経)にも作用することで、痛みが緩和している可能性が考えられます。また中和抗体を全身に投与することは、副作用の発生頻度を増加させる恐れがあります。そのため、より安全性の高い、病変部位への局所投与により鎮痛効果が得られることが実証されれば、HMGB1に対する中和抗体の鎮痛薬としての有用性がさらに高まると思われます。そこで、神経障害性疼痛モデルマウスにおける傷害坐骨神経でのHMGB1の発現変化と、HMGB1に対する中和抗体を局所投与することによる鎮痛効果を検討しました。その結果、神経障害性疼痛モデルマウスの傷害坐骨神経において、対照群(神経に傷害のないマウス群)と比較してHMGB1発現量が増加することを明らかにしました。またこの増加は、傷害によって集積した炎症性細胞に依存していることが分かりました。さらに、傷害坐骨神経の周辺部にHMGB1に対する中和抗体を投与することにより、痛みが有意に緩和されることを発見しました。また傷害坐骨神経の周辺部で増加したHMGB1は、さらに別の痛み誘発物質を増加させることで痛みを慢性化させていることも明らかになりました(2015年12月3日付の日経産業新聞、J. Neurochem., 2016、図4)。
中和抗体は中枢部位には作用しにくいことが報告されており、HMGB1に対する中和抗体は、中枢部位だけではなく末梢部位(傷害神経)にも作用することで、痛みが緩和している可能性が考えられます。また中和抗体を全身に投与することは、副作用の発生頻度を増加させる恐れがあります。そのため、より安全性の高い、病変部位への局所投与により鎮痛効果が得られることが実証されれば、HMGB1に対する中和抗体の鎮痛薬としての有用性がさらに高まると思われます。そこで、神経障害性疼痛モデルマウスにおける傷害坐骨神経でのHMGB1の発現変化と、HMGB1に対する中和抗体を局所投与することによる鎮痛効果を検討しました。その結果、神経障害性疼痛モデルマウスの傷害坐骨神経において、対照群(神経に傷害のないマウス群)と比較してHMGB1発現量が増加することを明らかにしました。またこの増加は、傷害によって集積した炎症性細胞に依存していることが分かりました。さらに、傷害坐骨神経の周辺部にHMGB1に対する中和抗体を投与することにより、痛みが有意に緩和されることを発見しました。また傷害坐骨神経の周辺部で増加したHMGB1は、さらに別の痛み誘発物質を増加させることで痛みを慢性化させていることも明らかになりました(2015年12月3日付の日経産業新聞、J. Neurochem., 2016、図4)。
 私たちの身体には1日周期のリズム、いわゆるサーカディアンリズムが存在しており、これらは「時計遺伝子」とよばれる複数の遺伝子群により制御されています。近年の研究により、サーカディアンリズムは様々な生体機能を司っていることが明らかになっています。さらにこのリズムの異常が睡眠障害、循環器疾患、メタボリックシンドロームなどの発症に密接に関わっていることが示唆されています。
私たちの身体には1日周期のリズム、いわゆるサーカディアンリズムが存在しており、これらは「時計遺伝子」とよばれる複数の遺伝子群により制御されています。近年の研究により、サーカディアンリズムは様々な生体機能を司っていることが明らかになっています。さらにこのリズムの異常が睡眠障害、循環器疾患、メタボリックシンドロームなどの発症に密接に関わっていることが示唆されています。 最近、三環系抗うつ薬などのモノアミントランスポーター阻害薬が鎮痛効果を発揮することが明らかとなり、神経障害性疼痛などに臨床応用されています。一方で、その作用メカニズムについては様々な研究報告がなされています。我々は、モノアミントランスポーター阻害により増加するノルアドレナリンが脊髄グリア細胞活性を抑制するのではないかと推測し、その作用について研究を行っています。脊髄ミクログリアをノルアドレナリンで刺激しておくと、アドレナリンβ受容体を介してミクログリア活性化の指標であるp38MAPキナーゼのリン酸化や腫瘍壊死因子(TNF)の産生が著明に抑制されることを見出しました(Neurochem.Int., 2009)。また、脊髄アストロサイトに発現するアドレナリンβ受容体を刺激することにより、アストロサイト活性化の指標であるJNKリン酸化反応と、それに引き続いて誘導される炎症性ケモカインCCL2産生が著明に抑制される機構も存在していることが明らかとなりました(J. Cell Physiol., 2014)。加えて、神経障害性疼痛モデルに対して、β2アドレナリン受容体作動薬を脊髄くも膜下腔内に投与しますと疼痛が緩和され、かつ脊髄後角で認められるミクログリアとアストロサイトの活性化が減弱することが明らかになりました(Neurochem. Int., 2016, 図6)。
最近、三環系抗うつ薬などのモノアミントランスポーター阻害薬が鎮痛効果を発揮することが明らかとなり、神経障害性疼痛などに臨床応用されています。一方で、その作用メカニズムについては様々な研究報告がなされています。我々は、モノアミントランスポーター阻害により増加するノルアドレナリンが脊髄グリア細胞活性を抑制するのではないかと推測し、その作用について研究を行っています。脊髄ミクログリアをノルアドレナリンで刺激しておくと、アドレナリンβ受容体を介してミクログリア活性化の指標であるp38MAPキナーゼのリン酸化や腫瘍壊死因子(TNF)の産生が著明に抑制されることを見出しました(Neurochem.Int., 2009)。また、脊髄アストロサイトに発現するアドレナリンβ受容体を刺激することにより、アストロサイト活性化の指標であるJNKリン酸化反応と、それに引き続いて誘導される炎症性ケモカインCCL2産生が著明に抑制される機構も存在していることが明らかとなりました(J. Cell Physiol., 2014)。加えて、神経障害性疼痛モデルに対して、β2アドレナリン受容体作動薬を脊髄くも膜下腔内に投与しますと疼痛が緩和され、かつ脊髄後角で認められるミクログリアとアストロサイトの活性化が減弱することが明らかになりました(Neurochem. Int., 2016, 図6)。